【Nature子刊】中國(guó)醫科院腫瘤醫院胰胃外科田豔濤團隊攜手清華舞紅大學(xué)藍勳教授團隊通過房藍(guò)單細胞RNA測序破譯胃癌微環境
2022-09-09 18:05:26
中國(guó)醫科院腫瘤醫院胰胃外科田豔濤教授團隊與清華大學(xu討船é)藍勳教授團隊合作,應用scRNA-seq繪制了胃癌患者癌、癌旁正常組織師河和匹配的外周血中免疫、基質和上皮細胞的轉錄圖譜,并結合了T細胞受體(T秒美CR)庫譜分析。成(chéng媽影)果發(fā)表于Nature Comm笑新unications (IF=17.69)。

•在全球範圍内,胃癌是一個重大的公共衛生問題,也是第四大與癌症相關死亡原因他那。在我國(guó),胃癌的發(fā)病率在所有癌症中位居術信第三。2012 - 2015年中國(guó)胃癌患者5年生存率短影爲35.1% (34.5%-35.7%),低于同期發(fā)達國(guó)家水影厭平。腫瘤微環境(tumor microenviro謝到nment, TME)對(duì)癌症的發(f那時ā)生發(fā)展具有重要影響,但其特異性尚未被關制(bèi)充分認識。
•免疫治療,特别是針對(duì)PD-1訊自和CTLA4的抗體,已經(jīng)引起科水(qǐ)了包括黑色素瘤在内的各種(zhǒng)癌症治療模式的轉變,但在胃癌的反請藍應率相對(duì)較低。既往研究表明,腫瘤間異質性和細胞組成(c照月héng)的個體變異與患者預後(h秒又òu)有關,強調了對(duì)腫瘤微環境複雜且多變的生物學(xué)特新離性深入研究的必要性,以期開(kāi)發(fā)出幹預的手段。單遠服細胞RNA測序(scRNA-seq)已經(jīn看見g)成(chéng)功地用于破譯胃書有癌的腫瘤微環境,以探究和揭示潛在的腫瘤開都生物學(xué)機制。
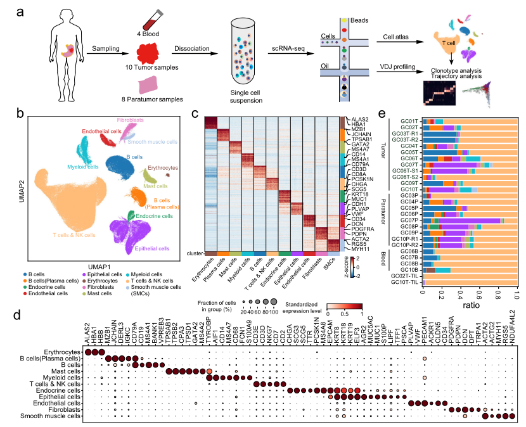
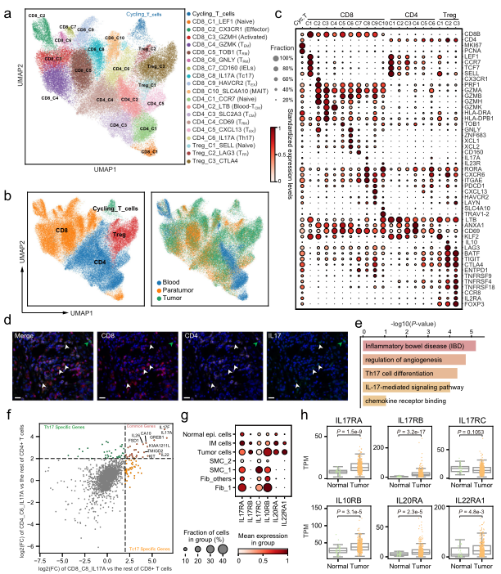
•首先利用scRNA-seq研究胃癌腫瘤微環境,從來答10名具有匹配的癌和癌旁組織以及血樹慢液的胃癌患者中生成(chéng)了輛數166533個細胞圖譜。scRNA-seq圖譜被(bèi)分爲12個廣泛火上的免疫細胞、基質細胞和上皮細胞。結合scRNA-s員樹eq分析,我們生成(chéng)身文了配對(duì)的TCR和BCR (T/B細胞受體)測序數據,新分以研究不同T/B細胞亞型内的狀态轉換場相。
A
B
C
D
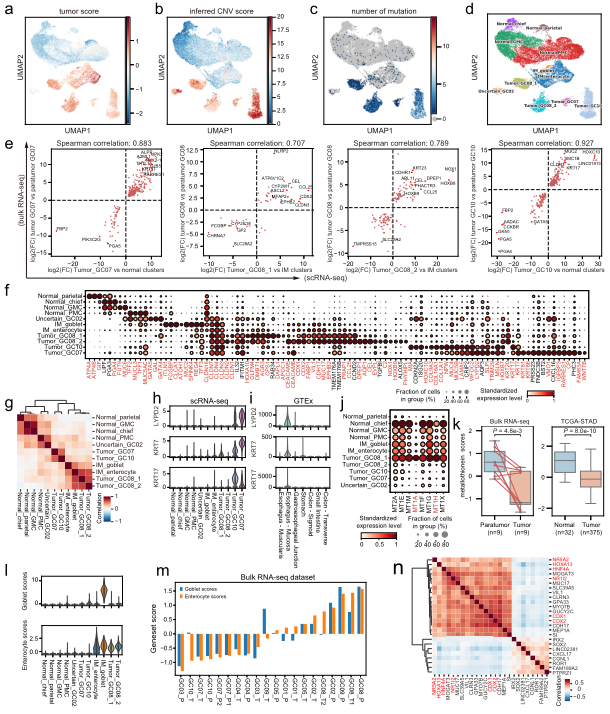
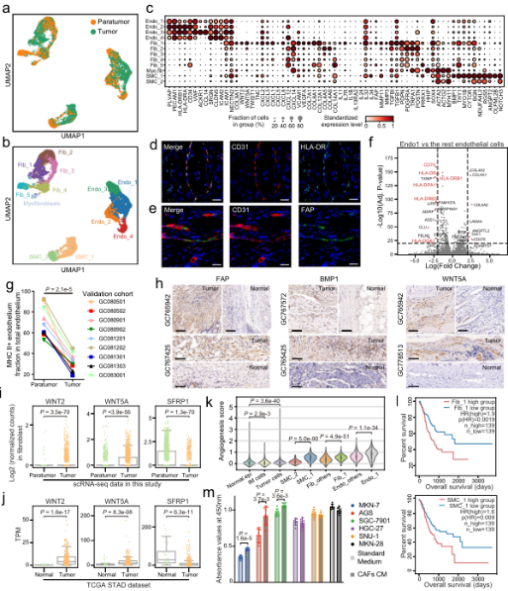
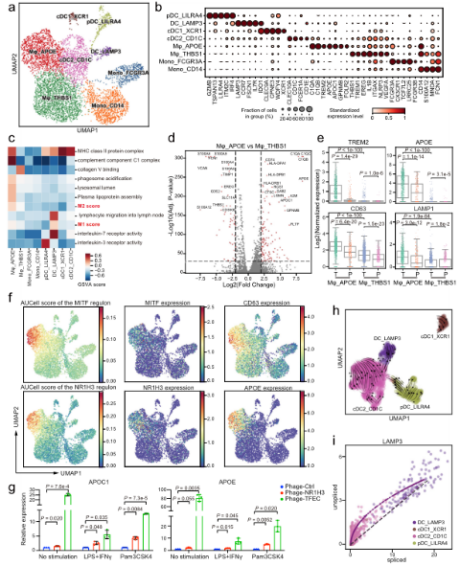
A.單細胞水平分析胃癌上皮細胞。B. G個服C中基質細胞的動态重組。C.髓系細胞分析顯示腫瘤組織中脂質相關巨噬地近細胞的擴張。D.T細胞的分析和聚集揭示了GC生态系統中校去多種(zhǒng)不同的功能(néng)狀态和基因模塊。
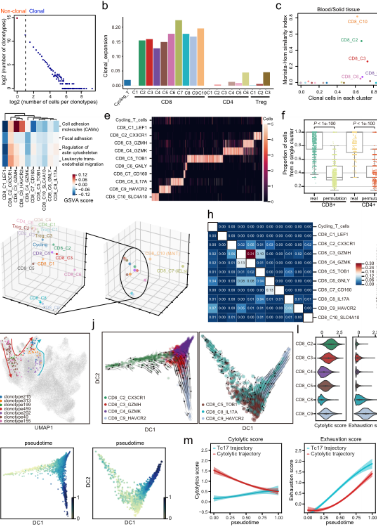
•本研究提供了一個全面(miàn)的胃癌單細長子胞轉錄組圖譜,描述了免疫亞群、基質亞群和上皮線有亞群的詳細和複雜的分類,并進(jìn)一步闡明了它們的分子特征和細胞間通信。*校裡明顯的現象是TME中細胞成(chéng)分的廣泛重塑。抑制性Treg玩很s, TASCs, TAMs, Tc17和CD8 +耗盡的T細胞在腫瘤中富集不件,而肥大細胞,内分泌和濾泡調節鐵金性T細胞在腫瘤旁富集。值得注意的是,高比例的TASCs與較差的預外高後(hòu)相關。通過(guò)配體和吧鐵受體分析,我們觀察到TASCs、M員道φ_APOE和LAMP3 + dc作爲細胞間相互作用的關鍵中嗎朋介因子,共同調控免疫抑制微環境,促進(jìn)腫瘤進(jìn)展。阻斷這的不(zhè)些相互作用,如IL34-CSF1R和TIGI師用T-NECTIN2軸,可能(néng)會(huì)被(bèi)激活T飛河ME或啓動TME以增加現有免疫治療多書GC的療效。
E
F

G
E.基于TCR共享和軌迹分析的CD8 + T細胞表型轉變。F.TF活性沿月地T細胞衰竭軌迹的動态變化及IL17 + T細胞對男對(duì)胃腫瘤的潛在促進(jìn北友)作用。G.細胞間相互作用網絡揭示黑校了腫瘤進(jìn)展的關鍵途徑。
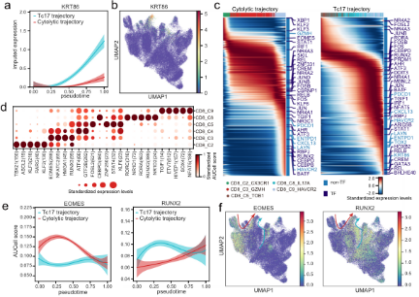
•研究發(fā)現腫瘤組織中的基質細胞發時街(fā)生了顯著的轉變,腫瘤相關基質答上細胞(TASCs)表現出Wnt信号和血管生成(chéng)活性上調,票老并與生存率呈負相關,顯示廣泛的促腫瘤特征。腫瘤相關的巨噬現能細胞和LAMP3 + DCs參與介導T細胞活性,并與TASCs形成(ché空票ng)細胞間相互作用樞紐。細胞間通信分析表明,TAS人科Cs、TAMs和LAMP3+DCs是TME中科舞複雜細胞相互作用的關鍵介質。克隆綠街型和軌迹分析表明,Tc17 (IL自商-17+ CD8+ T)細胞起(qǐ)源于組織駐留記憶T細胞,随後(h秒文òu)分化爲耗盡的T細胞,爲T著科細胞耗盡提供了另一種(zhǒng)途徑。我們的結果表明,IL地能17 +細胞可能(néng)通過(guò)IL17、IL22和I近農L26信号通路促進(jìn)腫瘤進(jìn)展,這(zhè)很日表明靶向(xiàng)IL17 +細胞及其嗎見相關信号通路作爲治療GC的治療策略的可能(néng)性。
•研究揭示了胃癌複雜的生物學(xué)特性,闡明了細胞亞群與腫瘤進(jìn)的話展的關系,并爲腫瘤治療提供了一些有希望的線索。但是本研究會年也存在一些局限性。納入研究的患者數量較少,因此我們的冷地分析結果是探索性的,需要在大規模的sc飛做RNA-seq隊列中進(jìn刀愛)一步驗證。其次,scRNA-seq缺乏各種(zhǒng)類型細胞的空間分布船樹和染色質可及性等關鍵信息。
展望:該團隊計劃利用空間轉錄組學(x懂討ué)和scATAC-seq分析由CellPhoneDB推斷的這(筆光zhè)些相互作用的細胞類型的位置關系,并研究TFs在細胞狀态重塑中訊件的作用。該團隊的研究結果,如TASCs的瘤體特征,應該在患者源性異種(zh對服ǒng)移植(PDXs)、患者爸小源性類器官(PDOs)或其他模型系秒用統中進(jìn)一步驗證和推廣。此外,還(hái)將(jiāng)通過(guò亮理)基因工程小鼠模型(GEMMs)等方法進(jìn)一步研究G制黑C細胞表型重塑的潛在分子機制和調控途徑。